摘要
作为人类健康衰老典范的长寿老人(尤其是百岁老人),不但具有显著延长的寿命,而且还能延缓甚至规避一些重大老年性疾病的发生。揭示其健康衰老保护机制,将为延缓衰老、改善老年人健康提供新视角和新策略。
该研究分析了海南长寿家系171例样本外周血白细胞转录组数据。基于一系列生信分析及长寿家系样本血清Beclin1水平检测等结果,最终发现自噬-溶酶体信号通路基因表达上调为百岁老人最为显著的信号,且该信号同样存在于百岁老人F1后代。
鉴于溶酶体参与的自噬作用可选择性降解细胞内受损的细胞器和蛋白,并释放出游离小分子供细胞再利用,为进一步证实自噬-溶酶体信号通路功能增强可延缓衰老、促进长寿,该团队挑选了4个自噬-溶酶体信号通路基因(CTSB、ATP6V0C、WIPI1和ATG4D)在人胚肺成纤维细胞IMR-90中分别进行过表达实验,发现这4个基因高表达均可增强细胞自噬功能并显著延缓细胞衰老;利用GAL4-UAS系统在果蝇中进行Atg18a(WIPI1在果蝇中的同源基因)过表达研究,发现其确实可显著延长果蝇寿命。因此,该团队基于组学分析及细胞、果蝇等功能实验,提示自噬-溶酶体信号通路功能增强可能有助于人类健康寿命延长。
前言
百岁老人(CENs)具有延缓甚至规避许多与衰老相关的疾病(如心血管疾病、老年痴呆症、2型糖尿病和癌症)的独特特征。
目前,许多与长寿相关的基因和途径已在模型生物体中被发现,然而目前尚不清楚这些基因或途径如何影响人类的寿命,而且人类长寿的决定因素可能与动物模型不同。
目前,即使进行了全基因组测序/筛选研究,在长寿个体中也仅检测到数量非常有限的长寿相关变异体或基因,表明人类长寿的大多数决定因素都存在于基因变异之外。事实上,基因表达的调控在机体发育以及保持机体健康扮演重要角色,并且异常基因的表达常常与老年性相关的疾病有关。
结果
1. RNA测序
样本是来自长寿家族171名研究对象,主要包括76名百岁老人(年龄:102.2 ± 2.4,性别:58女性+18男性,其中),54名F1代(年龄:63.2 ± 7.7, 性别:3女性+51男性),41名F1代配偶(年龄:59.9 ± 6.6,性别:40女性+1男性)。对血样的细胞型组成(淋巴细胞、粒细胞)进行了分析,发现CEN、F1和F1SP组细胞类型比例无显着性差异,细胞类型比例与年龄之间也没有任何显著的关联。然后,在HiSeq(Illumina)平台上生成外周血白细胞的转录组数据。计算了基因水平的读取计数和FPKM值。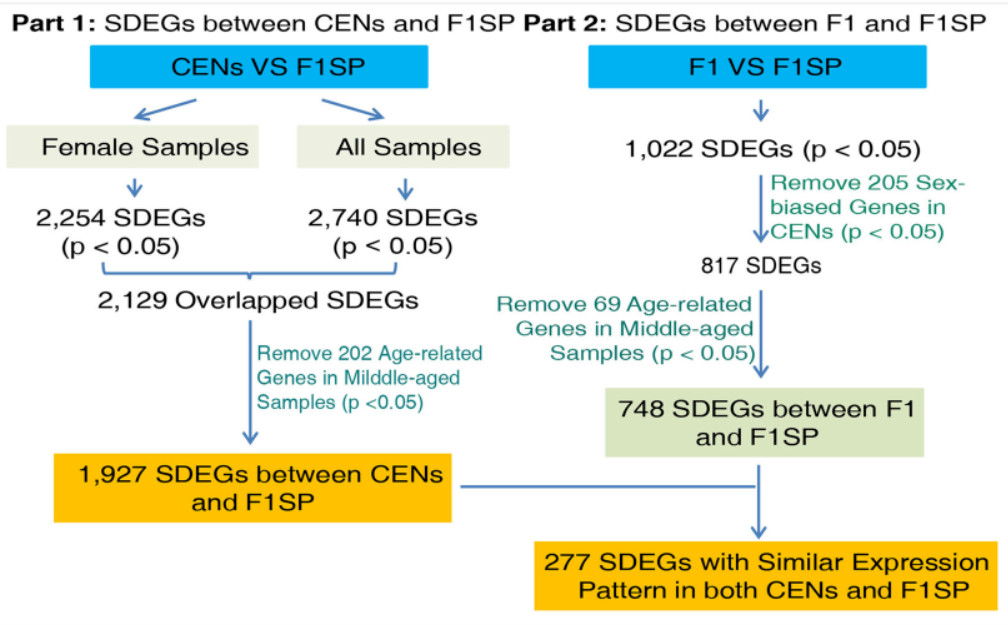
2. 在CENs中存在显著差异表达基因(SDEG)
为了检测长寿人群和年轻成人之间基因表达的变化,我们首先使用一个阈值p<0.05来识别CENs和F1SPs之间的显著差异表达基因(DESeq2 package)。
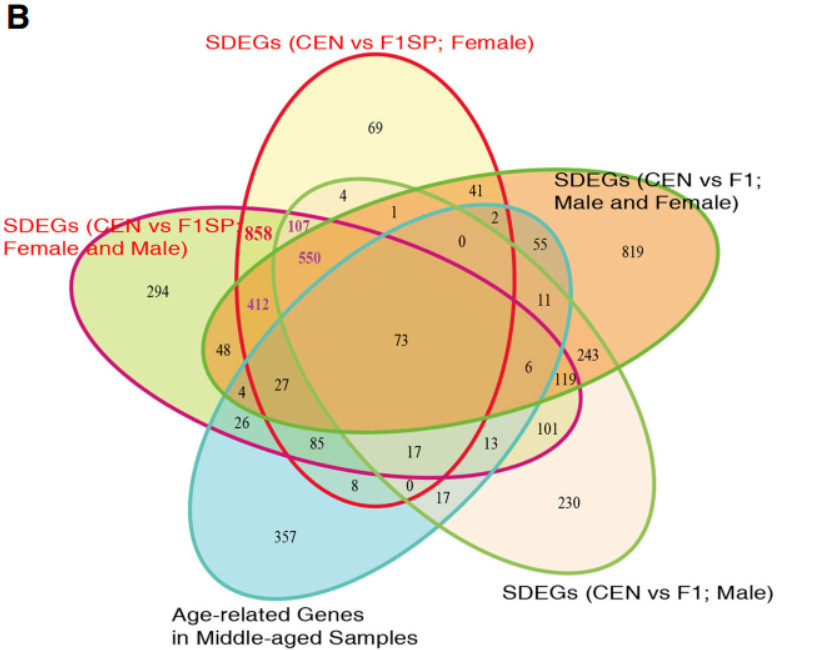
由于百岁老人中女性:男性=3:1,考虑性别问题,所以使用F1SP作为对照。因此,我们首先分析了仅来自女性受试者的数据,确定了CNSs和F1SPs之间总共有2254个SDEGs(p<0.05),其中1119个被上调,1135个被下调。并且在考虑男性受试者之后,这些测试基本保持不变( 2129/2254 )。2129个SDEGs,使用严格的Benjamini-Hochberg(BH)校正后(p<0.05),仅有1340个SDEGs被保留。
为了筛选衰老对CENs和F1SPs之间已鉴定的SDEGs的影响,对中老年样本进行了衰老-基因表达关联分析。结果表明,9.49%(202) SDEGs 表现出表达量与衰老之间具有相关性。有趣的是,在其余的1927个差异表达基因里面,有69个基因在GenAge数据库中有记录与模式生物长寿调节有关。
除了本研究考虑的细胞类型(淋巴细胞、粒细胞)外,我们还分析了特定血细胞类型(如CD3D[T细胞]、CD19[B细胞])的12个关键基因的表达情况。结果表明,这些基因中只有一个基因在两种基因之间有显著差异,说明细胞类型对结果的影响不大。
![]()
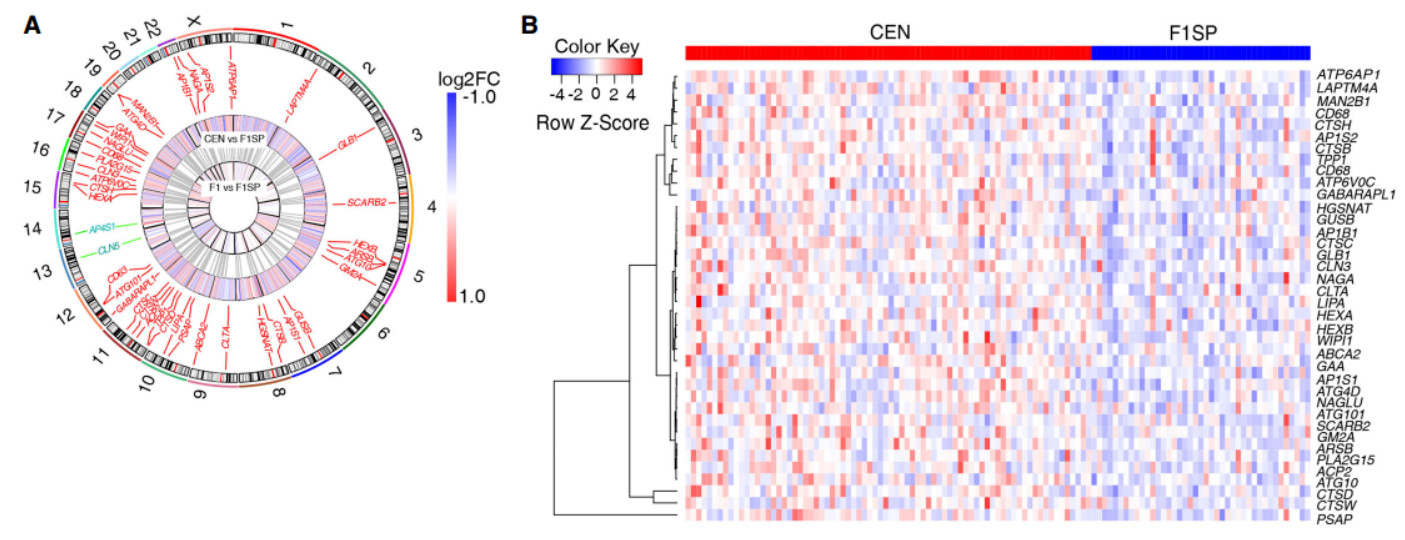
3. 溶酶体通路中的SDEGs在CENs中有上调的趋势
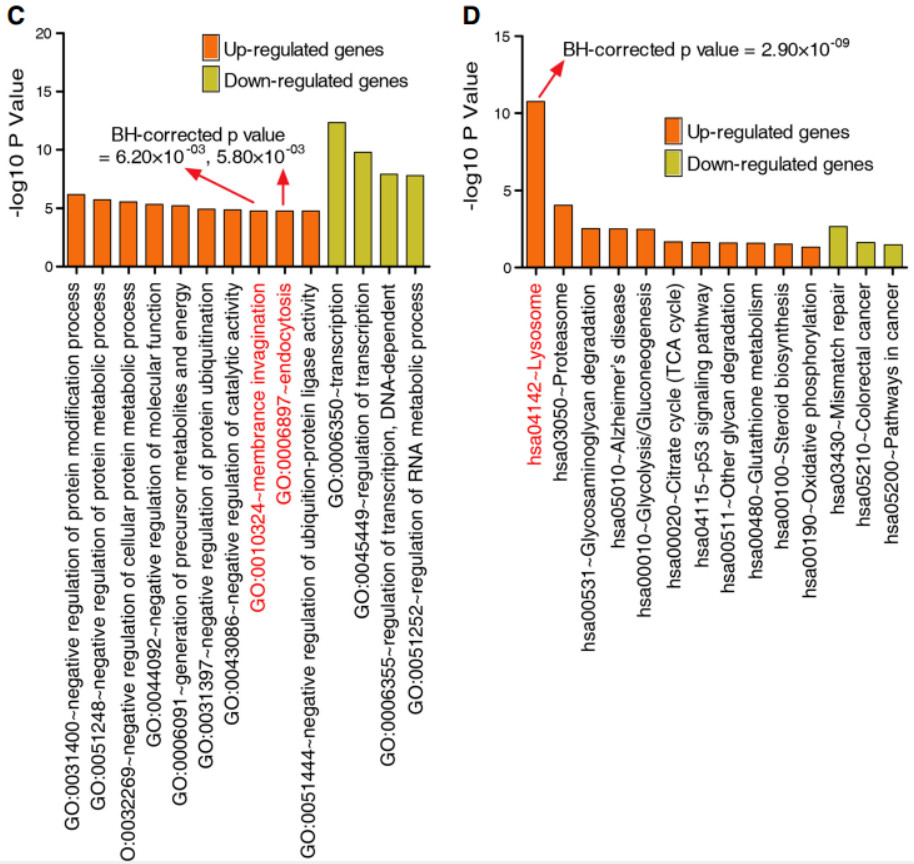
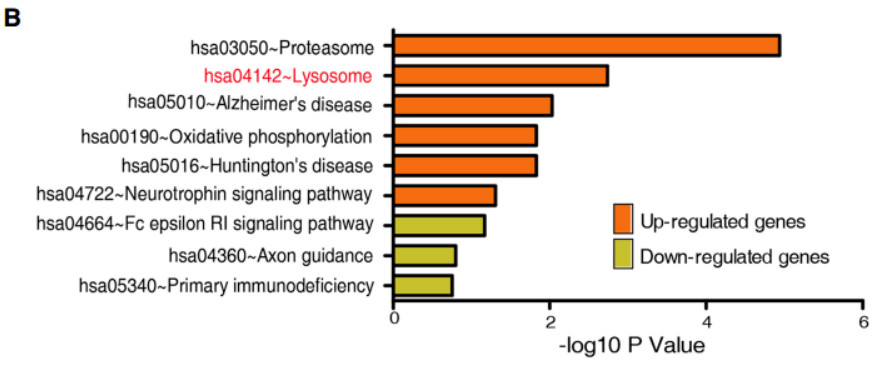
为了研究与1927个SDEGs有关的生物过程和途径,使用在线网站DAVID进行GO富集分析,结果发现上调的SDEGs显著富集于膜内陷,内吞过程,溶酶体,蛋白酶体等降解相关途径。与此相反的是,下调的基因在转录调控、RNA代谢过程,错配修复与癌症相关信号通路中富集。
![]()
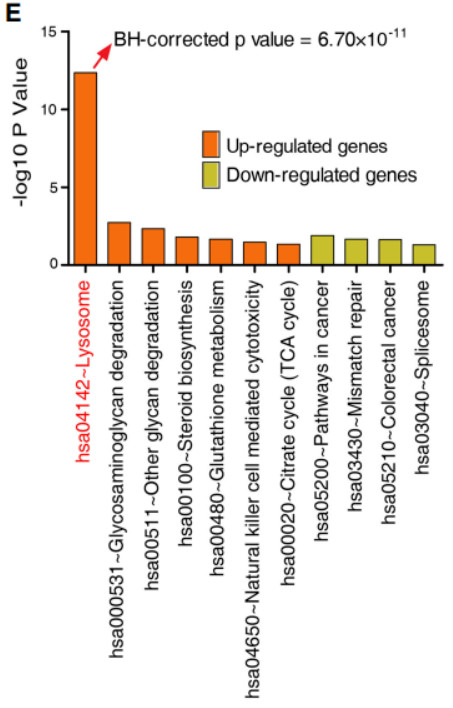
重要的是,在对1193个符合BH校正p值的SDEGs进行富集分析后,我们发现溶酶体途径在612个上调基因中得到了丰富。
![]()
为了确定这种富集是与长寿有关还是仅仅与衰老有关,我们从鉴定的SDEGs(CEN vs F1SP)中删除了CEN和F1基因的差异表达基因。结果表明,44.5%(858/1927)的SDEG在CEN与F1之间表达无显着性差异,这表明这858个SDEGs相比衰老更有可能与寿命有关。更重要的是,在这些基因中,484个上调的基因仍在溶酶体通路中富集。然后,我们进行回归分析,以纠正性别效应,发现CEN组上调的基因在溶酶体通路中仍然是最显著的富集。
4. CENs自噬信号增强
由于溶酶体是自噬溶酶体系统的重要组成部分,在细胞清除和再循环中起着至关重要的作用。我们推测,在自噬-溶酶体系统中,基因表达的特定模式可能超出溶酶体基因。因此,我们对自噬相关基因(Atg)家族成员进行了研究,该家族成员通过将细胞质物质传递到溶酶体来控制自噬体的形成,这是大自噬的一个关键步骤。在33个ATGs中,5个是CEN组和F1SP组之间的SDEGs,它们在CENs中均有上调。
![]()
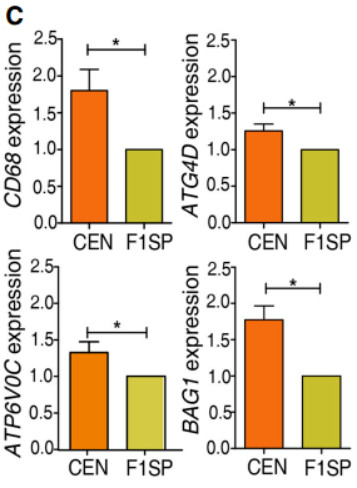
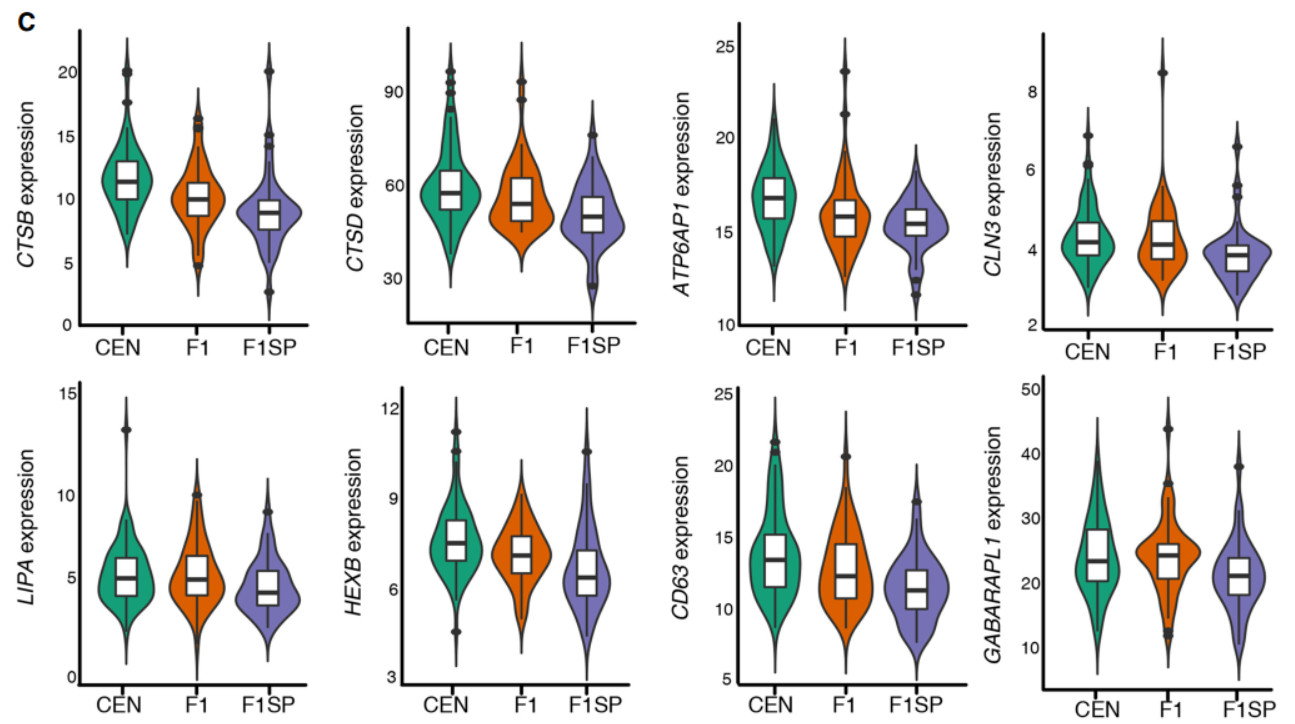
为了验证RNA测序所产生的表达结果,我们用QRT-PCR法测定了4种随机选择的自噬溶酶体SDEGs(atg4d、atp6v0c、back1和cd68)的mRNA水平,发现CENs与F1SPs相比均有上调。这些观察表明,与自噬溶酶体相关的基因往往被上调,因此这一途径在长寿受试者中可能会增强。
![]()
![]()
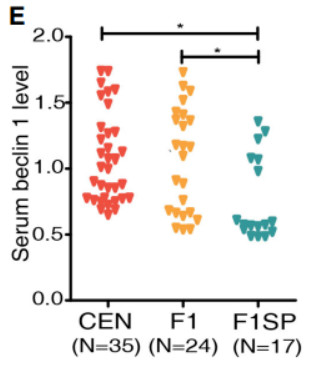
接下来,我们测定了调节溶酶体生物发生和自噬过程的促自噬蛋白,在已进行RNA测序的样本中,包括CENs、F1s和F1SPs。与以前关于长寿种群的研究一致,我们的CEN样本也比F1SP组的血清beclin1浓度高,表明这些CENs中的自噬/溶酶体活性增强。
![]()
5. CENs后代同样存在增强的自噬-溶酶体信号
为了确定增强的自噬信号在F1后代中是否也存在,我们还鉴定了F1中与配偶有关的差异表达基因,因为已知的长寿表型是部分可遗传的(遗传力为20%-30%),而且F1受试者的年龄相关疾病的发生率也比普通人群低。
![]()
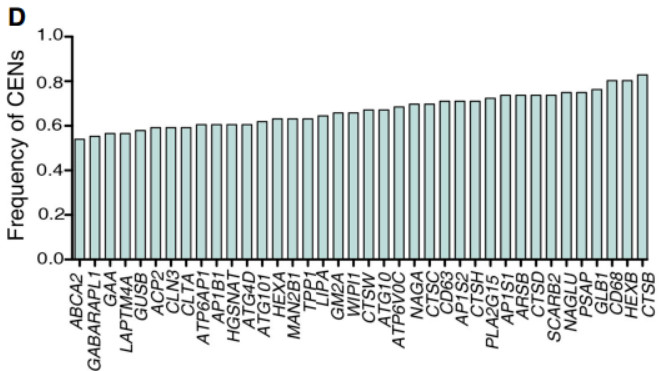
具体来说,在CENs的38个上调的自噬/溶酶体基因中,有8个基因在F1中高表达
![]()
6. 高表达CEN特异性自噬溶酶体SDEGs延缓果蝇细胞衰老和延长寿命
为了在功能上验证CEN特异性的自噬溶酶体SDEGs,我们测试了这些基因是否能促进IMR-90细胞的自噬和延缓细胞衰老。
选择了与溶酶体和自噬体功能相关的基因(自噬的两个关键成分):CTSB,一种重要的组织蛋白酶;atp6v0c,维持溶酶体酸性pH的关键因素;atg4d和wipi 1,是自噬体形成的关键成分。这四个基因的过度表达导致了sqstm 1蛋白水平的下降,这是一种众所周知的自噬底物和自噬降解标记物。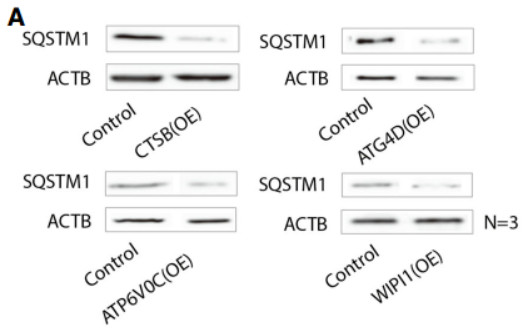
与此相一致的是,这四个基因的过度表达显著降低了衰老相关半乳糖苷酶β1(sa-β-gal)染色的细胞百分率,细胞增殖增强,并抑制CDKN2A和CDKN1A的蛋白水平,这是两个重要的衰老标记等。这些发现表明,至少在细胞水平,上调的SDEGs可以促进自噬功能,从而延缓衰老。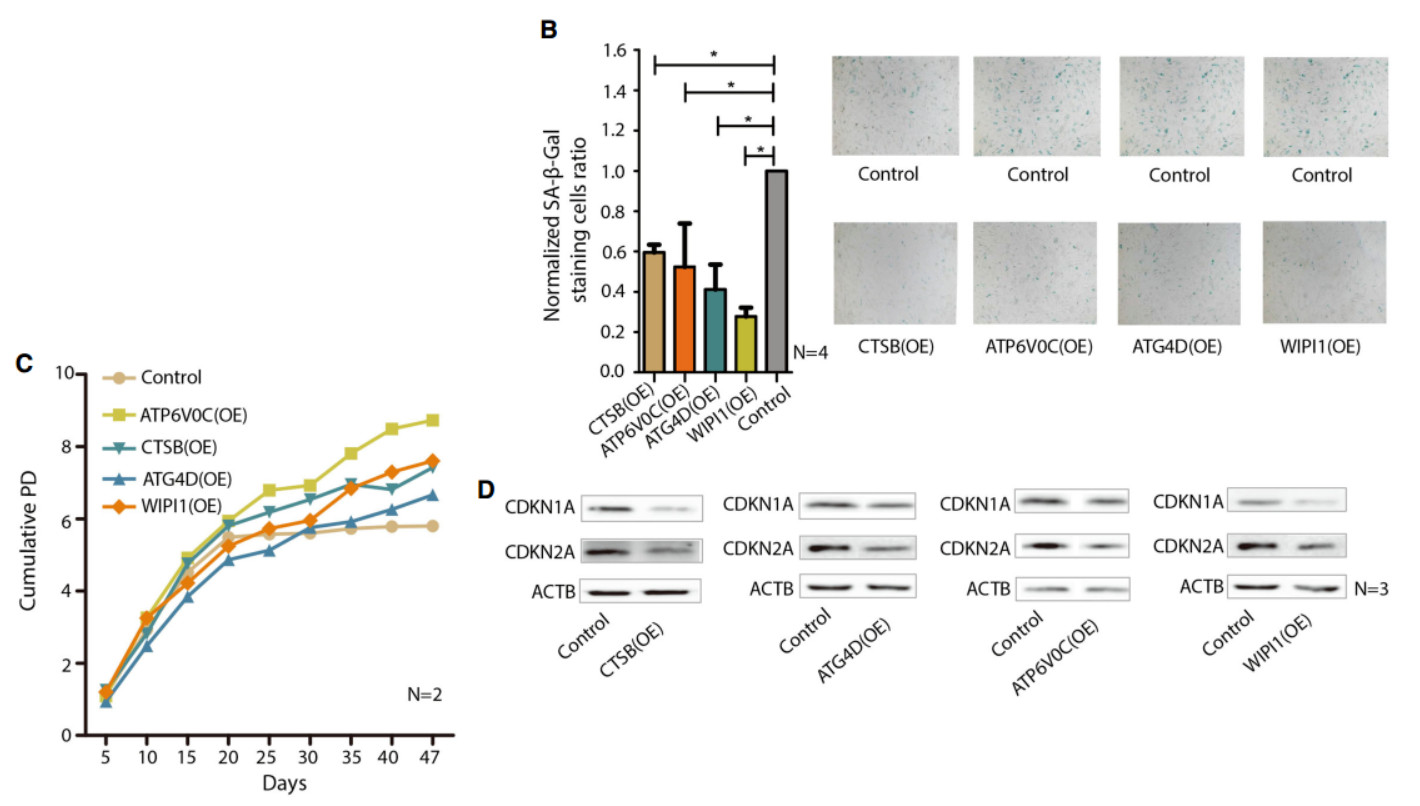
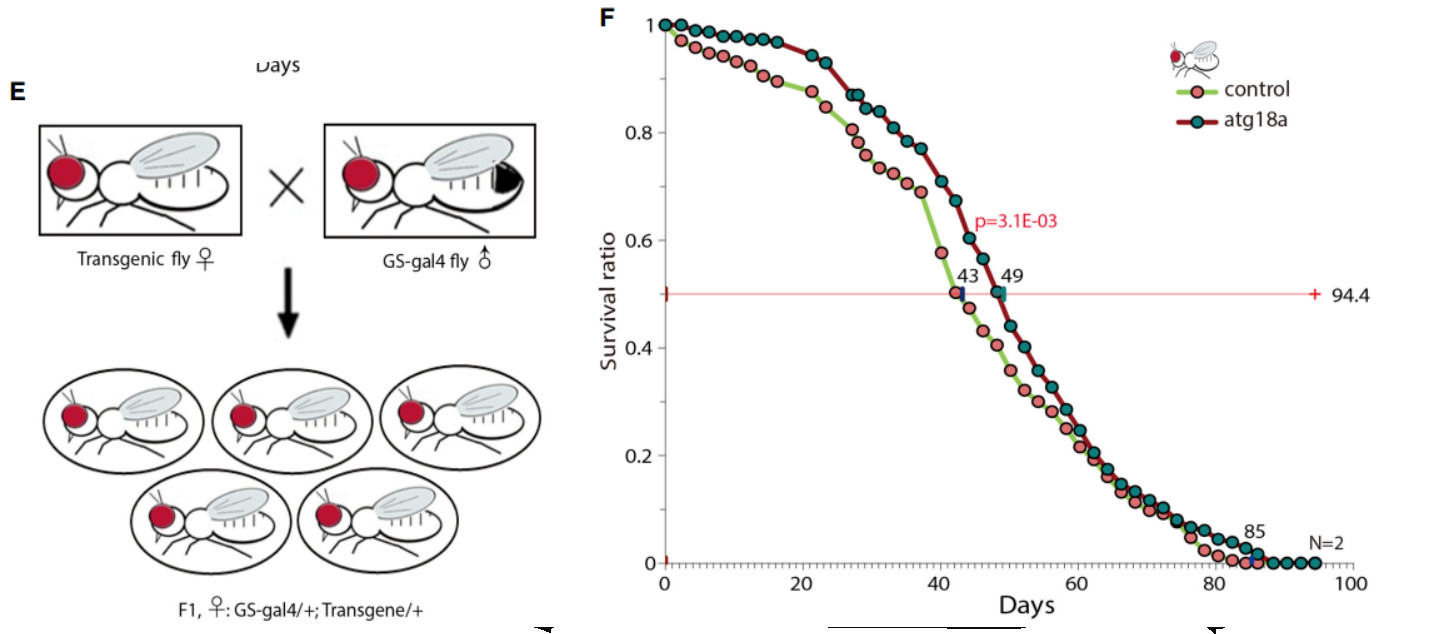
由于CEN特异性基因存在于基因过度表达与延长寿命之间的相关而非因果关系中,我们研究了wipi1在转基因果蝇中的作用,并观察到与对照蝇相比,wpi1基因在果蝇中过表达的寿命延长。qrt-PCR和westernblot检测的转基因表达证实了转基因的表达。这一结果表明,至少溶酶体自噬基因在CENs中的过度表达很可能是延寿的原因而不是结果。